Cours de transformations chimique pour le Terminale S, Es et le Deug ( universitaire )
RAPPELS SUR LES ACIDES ET LES BASES
Acides et bases selon Bronsted.
Un acide est une espèce chimique capable de libérer l’ion hydrogène H+ selon une réaction du type :
AH est un acide : AH <> A– + H+
Exemples
HCOOH <=> HCOO− + H+
H2CO3 <=> HCO3- + H+
NH4+ <=> NH3 + H+
Une base est une espèce chimique capable de capter ion hydrogène H+ selon une réaction du type :
B une base : B + H+ => BH+
Exemples
NH3 + H+ <=> NH4+
HCO3- + H+ <=> H2CO3
Couple acide / base
Définition acide / base
Soit AH un acide qui libère les ions H+ et A– dans une solution :
AH => A– + H+
l’équation peut être inversée : A– + H+ => AH
A– peut capter H+ pour donner AH, donc A– est une base
A– est la base conjuguée de AH alors AH et A– forment un couple acide-base conjugués noté : (AH / A–).
A tout couple acide / base on associe une équation de réaction du type :
AH <=> A– + H+.
Le signe <=> montre que la réaction s’effectue dans les deux sens.
Exemples:
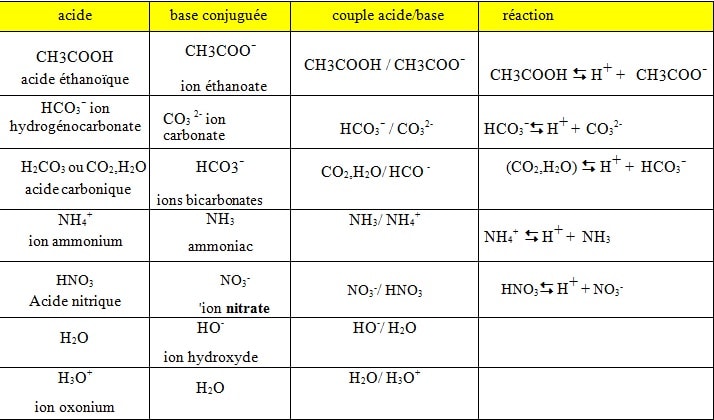
CH3COOH / CH2COO– acide éthanoïque / ion éthanoate
CH3COO– est dite base conjuguée de l’acide CH3COOH
CH3COOH est dit acide conjugué de la base CH3COO–
Demi équation correspondant à ce couple : CH3COOH <=> CH3COO– + H+
Exemple de quelques couples acide / base:
Les couples de l’eau
L’eau intervient dans 2 couples acide/base qui sont : H2O / HO− et H3O+ / H2O.
Il joue le rôle d’acide dans un couple et de base dans l’autre c’est un ampholyte
l’eau est l’acide du couple acido-basique : H2O/HO–
H2O(l) <=> HO–(aq) + H+
l’eau est la base du couple acido-basique : H3O+/H2O
H2O(l) + H+ <=> H3O+(aq)
Réaction acido-basique
Toute réaction acido-basique est un transfert de l’ion H+ de l’acide noté HA1 du couple acido-basique HA1 / A1– vers la base notée A2– de l’autre couple acido-basique HA2 / A2–:
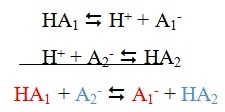
Exemples : réaction entre l’acide éthanoïque et l’ammoniac
CH3COOH / CH3COO− et NH4+ / NH3
CH3COOH <=> CH3COO− + H+
NH3 + H+ <=> NH4+
CH3COOH + NH3 <=> CH3COO− + NH4+
Définition et mesure de 𝒑𝑯 d’une solution aqueuse
Notion de pH d’une solution aqueuse
Définition
Le pH est lié à la concentration molaire des ions oxonium H3O+ dans une solution aqueuses
Le pH est donné par la relation :
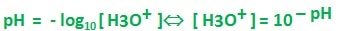
- Le pH mesure l’acidité d’une solution aqueuse diluée
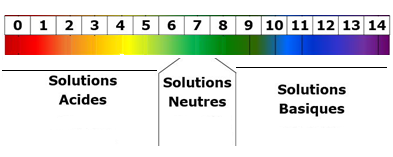
- Le pH est une grandeur sans unité qui permet de distinguer les solutions acides, basiques et neutres
- [H3O+] exprimé en en mol.L-1 est la concentration de la solution en ions oxonium H3O+.
- log10 : le logarithme décimal
Exemples :
[H3O+] = 1,6.10-2 mol.L-1 : pH = 1,8.
On peut déterminer la concentration en ions oxonium à partir du pH:
10-pH = [H3O+]
pH = 3 : [H3O+] = 10-3 mol.L-1.
La fonction logarithme est une fonction croissante donc:
|
pH grand <=> [H3O+]
petit pH petit <=> [H3O+] grand |
Mesure du pH
Il existe différentes méthodes pour mesurer le pH d’une solution.
Papier pH
L’utilisation d’un papier pH qui change de teinte en fonction du pH de la solution est une méthode approximative.
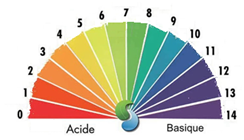
- On trempe le papier dans la solution
- A chaque couleur du papier correspond une valeur de pH selon l’acidité de la solution.
Les indicateurs colorés
- Un indicateur coloré de pH est un mélange d’espèces acido-basiques qui changent de couleur selon le pH du milieu.
- Il se trouve sous deux formes, chaque forme ayant sa propre couleur.
- Il s’agit de couples (acide-faible /base faible) (HIn / In–) HIn et In– ont des couleurs différentes dans la solution en fonction de leur concentration:

PH-Mètre
- Le pH-mètre est un appareil de mesure qui permet de déterminer avec précision le pH d’une solution. Il est constitué généralement d’une électrode en verre reliée à un à un voltmètre électronique gradué en unité de pH.
- Étalonnage est obligatoire avant toute mesure.
- Mesurer le 𝒑𝑯 d’une solution aqueuse est de déterminer la concentration en ions oxonium [𝑯𝟑𝑶+], ainsi que l’état final d’une réaction chimique.

Les transformations totales et non totales
La transformation totale
Réaction entre un acide et l’eau
Solution d’acide chlorhydrique :
- On verse, dans un bécher, un volume V=100ml de solution d’acide chlorhydrique gazeux HCl de concentration 3,5.10–2 mol.L-1
- Après stabilisation on mesure par Ph-mètre : la valeur indiqué est pH=1,45
La réaction de HCl avec H2O s’écrit :
HCl(g) + H2O(l) => H3O+ + Cl–
Tableau d’avancement
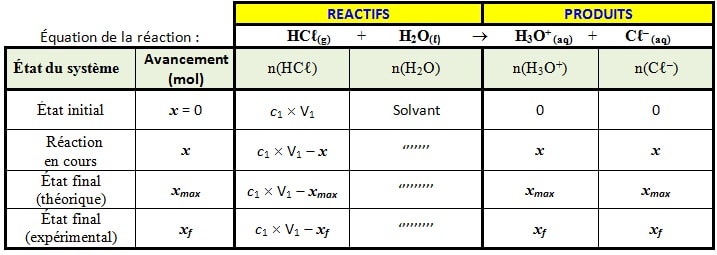
Calcul l’avancement maximal de la réaction xmax
Puisque l’eau est en excès, alors le réactif limitant est 𝑯𝑪𝒍 d’où :
C1 xV1 – xmax=0
xmax =C1 xV1= 3,5.10–2´100. 10–3= 3,5. 10–3 mol
Calcul de xf :
(le pH est déterminé expérimentalement). pH=1,45
Par définition pH = – log[H3O+] <=> [H3O+] = 10–pH =10–1,45 =3,5.10–2 mol L-1
De plus, d’après le tableau d’avancement :
xf = n(H3O+) = [H3O+]xV1 = 10–pH x V1=3,5. 10–3 mol
On remarque que : xmax = xf
On déduit alors que l’acide chlorhydrique gazeux HCl est consommé totalement ,alors on dit que la réaction est totale
Résumé: Une transformation totale s’arrête d’évoluer au cours du temps ce qui montre la disparition totale d’au moins un des réactifs du système chimique.
La Transformation non totale ou limitée
Solution d’acide éthanoïque :
Considérons une solution de concentration C2 = 5,0.10-4 mol.L-1 et volume V2 = 50 mL, on mesure le Ph de la solution par Ph-mètre : la valeur indiqué est pH=4
Les deux Couples acide / base sont :
CH3COOH(aq) / CH3COO– (aq) et H3O+/ H2O(l)
L’équation de réaction acido-basique entre l’acide éthanoïque et l’eau:
CH3COOH(aq) + H2O(l) <=> CH3COO– (aq) + H3O+
Le tableau d’avancement de la réaction:
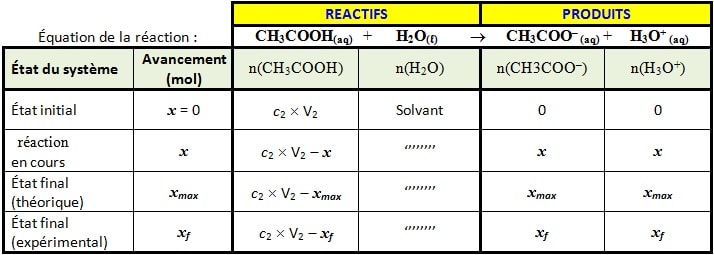
Calcul l’avancement maximal xmax
Puisque l’eau est en excès, alors le réactif limitant est CH3COOH(aq) d’où :
C2 x V2 – xmax=0
xmax =C2 x V2 = 5.10-4 x 50.10-3 = 2,5.10-5 mol.
Calcul l’avancement final expérimental xf
(le pH est déterminé expérimentalement). pH=4
Par définition pH = – log[H3O+] <=> [H3O+] = 10–pH =10–4 mol L-1
De plus, d’après le tableau d’avancement :
xf = n(H3O+) = [H3O+]x V2 = 10–pH x V2 = 10–4 x 50. 10–3 mol = 5.10-6 mol
On remarque que L’avancement final (expérimental) xf est inférieur à l’avancement maximal (théorique) xmax.
xf < xmax
Puisque xf < xmax donc la réaction n’est pas totale
Résumé: Les réactifs de la transformation non totale ou limitée ne se disparaissent pas totalement.
Le taux d’avancement final d’une réaction chimique
Le taux d’avancement d’une réaction est égal au quotient du taux d’avancement final par le taux d’avancement maximal :
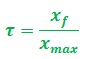
- 𝝉 est une grandeur sans unité 0≤𝝉≤𝟏 et peut être exprimée en pourcentage.
- Si 𝝉=1 la réaction chimique est total
- Si 𝝉<1 la réaction chimique est non total
Réaction s’effectuant dans les deux sens.
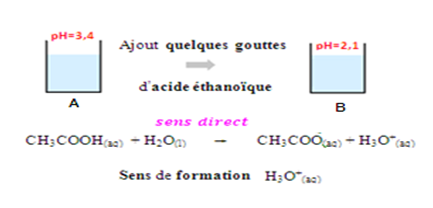
On prépare une solution aqueuse d’acide éthanoïque de pH=3,4.
On la verse, dans les béchers A et B équitablement
On ajoute, dans le bécher A , quelques gouttes de l’acide éthanoïque
on remarque que le pH prend la valeur 2,1
Dans le bécher A, le pH diminue (il passe de 3,4 à 2,1) donc la concentration des ions H3O+ augmente, ce qui montre que la réaction s’effectue dans le sens direct
Sens Direct
CH3COOH(aq) + H2O(l) => CH3COO– (aq) + H3O+(aq)
On ajoute, dans le bécher B , quelques gouttes d’éthanoate de sodium
on remarque que le pH prend la valeur 4,2
Dans le bécher B, le pH augmente (il passe de 3,4 à 4,2) donc la concentration des ions H3O+diminue, Ce qui montre que la réaction précédente s’effectue dans le sens inverse
sens indirect
CH3COO–(aq) + H3O+(aq) => CH3COOH(aq) + H2O(l)

Par conséquent la réaction limitée entre l’acide éthanoïque et l’eau peut s’effectuer dans les deux sens (le sens direct et le sens indirect de l’équation de la réaction), on la modélise avec l’utilisation du signe <=>
CH3COOH(aq) + H2O(l) <=> CH3COO–(aq) + H3O+(aq)
L’état d’équilibre d’un système chimique
A l’état final d’une transformation non totale (limitée), le système chimique cesse de s’évoluer c’est-à-dire les concentrations de tous les réactifs et produits restent fixes au cours du temps . on appelle cet état : état d’équilibre dynamique
Exemple : de la solution aqueuse d’acide éthanoïque
les quatre espèces CH3COOH(s), H2O(l), CH3COO–(aq) et H3O+(aq) de la réaction d’équation coexistent dans le système à des proportions fixes
On dit que ce système chimique est en équilibre dynamique.
Résumé: Un système chimique, est en équilibre si les concentrations de ses constituants restent constantes au cours du temps
Si vous avez des questions, Merci de laisser un commentaire, l’équipe COURSUNIVERSEL vous répondrez le plutôt possible








L’exact 💪🏿💪🏿💪🏿💪🏿💪🏿❤️❤️❤️
Merci pour votre commentaire 🙂
Merci beaucoup ❤️❤️❤️❤️