Table des matières
Suivi temporel de la transformation chimique
Suivre l’évolution de la transformation chimique c’est connaître l’avancement 𝒙 en fonction de temps 𝒙 =f(𝒕).
Les méthodes qui permettent de suivre l’évolution d’une transformation sont :
Méthode chimique : Le dosage, les mesures se font en discontinu
Méthodes physiques : Les mesures se font en continu par différents instruments de mesure :
- La conductimétrie: (liées à la concentration en ions)
- PH-métrie: Pour les milieux réactionnels contenant des ions oxonium H3O+
- Mesure de la pression : cas d’espèces gazeuses.
- La spectrophotométrie : l’absorbance au cours du temps A(t), dans le cas d’espèces colorées
Les chapitres suivantes illustrent les méthodes les plus utilisées en chimie (Suivi temporel d’une transformation chimique) Vitesse de réaction ou cinétique
Suivi temporel d’une transformation chimique par dosage
Étude de la réaction entre l’eau oxygénée H2O2 et l’ion iodure K+(aq)+I–(aq))
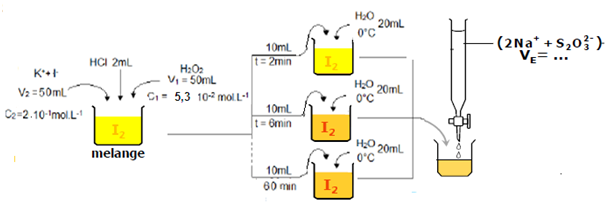
A l’instant t = 0 s, on mélange dans un erlenmeyer de 250 mL un volume V1=50,0mL d’eau oxygénée H2O2 de concentration C1= 0,053.mole.L-1, avec un volume V2=50,0mL de solution aqueuse d’iodure de potassium (K+(aq)+I–(aq)) , de concentration C2=0,20mole.L-1, ainsi quelques goutes d’acide sulfurique
Après agitation on observe que le mélange prend une couleur jaune , puis marron et en fin une couleur brun dû à la formation de I2, c’est une réaction lente.
La réaction met en jeu par les couples:
H2 O2 (𝒂𝒒) /H2 O (𝒍) et I2(𝒂𝒒) / I–(aq).
L’équation de la réaction s’écrit :
H2 O2 (𝒂𝒒)+ 2 I–(𝒂𝒒) + 2H+(𝒂𝒒) → I2(𝒂𝒒)+ 2H2 O (𝒍)
Pour savoir la quantité diiode formé à chaque instant, on prélève 10ml du mélange réactionnel et on la trempe dans l’eau glacée 0°C afin de bloquer la formation de I2 ,puis on la dose par une solution aqueuse titrante de thiosulfate de sodium (𝟐𝑵𝒂+(𝒂𝒒) , S2O32-(𝒂𝒒)) , On répète l’opération dix fois successivement de « t1=0min ; t2=2min……à t10=50 min »
Dosage de diiode I2
On dose le diiode formée I2 par une solution aqueuse titrante de thiosulfate de sodium (𝟐𝑵𝒂+(𝒂𝒒) + S2O32-(𝒂𝒒)) de concentration 𝑪𝟑=𝟎,𝟎𝟐𝟎 𝒎𝒐𝒍.𝑳−𝟏 avec quelques gouttes d’empois d’amidon (qui se colore en bleu montrant l’existence de I2 diiode).
L’équation de la réaction de dosage est :
| I2(aq) + 2 S2O32-(aq) | => | 2 I– (aq) + S4O62- (aq) |
VE est le volume de la solution titrant versée à l’équivalence.
On repère L’équivalence par la disparition de la couleur bleue de I2 diiode
| t(min) | 0 | 2 | 6.0 | 10 | 15 | 20 | 25 | 30 | 40 | 50 |
| VE(mL) | 0 | 5,0 | 10 | 14 | 16 | 17 | 17,8 | 18,4 | 19 | 19,4 |
Tableau d’avancement permet de déterminer la relation, à l’équivalence entre les ions thiosulfate réactif titrant et le diiode I2 le réactif titré

À l’équivalence, on a n(I2) – xE =0 n(I2) = xE
C3 VE -2 xE=0 C3 VE=2 xE xE= C3 VE/2
Donc :
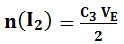
n(I2) la quantité de matière de I2 de chaque échantillon prélevé.
On a prélevé 10 échantillons alors, la quantité de matière de I2 formée à un instant donné dans le mélange est 10 fois n(I2)
n(I2) T : la quantité de matière formée total de I2 dans un erlenmeyer.
n(I2)T =10n(I2) donc n(I2)T = 5 C3 VE
En fin on a déterminé l’expression de la quantité de matière formée de n(I2)T en fonction du volume VE et la concentration molaire C3 de la solution de thiosulfate de sodium
On remplit le tableau:
| t(min) | 0 | 2 | 6.0 | 10 | 15 | 20 | 25 | 30 | 40 | 50 |
| VE(mL) | 0 | 5,0 | 10 | 14 | 16 | 17 | 17,8 | 18,4 | 19 | 19,4 |
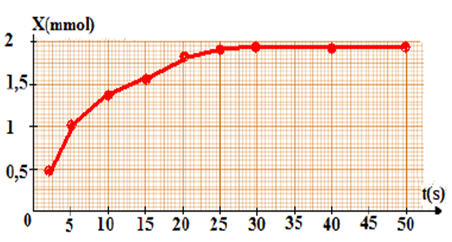
| n(I2) mmole | 0 | 0,5 | 1,0 | 1,40 | 1,60 | 1,70 | 1,78 | 1,84 | 1,90 | 1,94 |
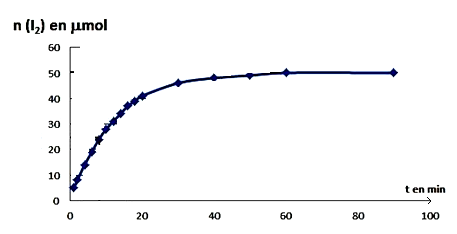
Conclusion : Le dosage nous permet de calculer n (I2) formé en fonction du temps
Le tableau d’avancement de la réaction:
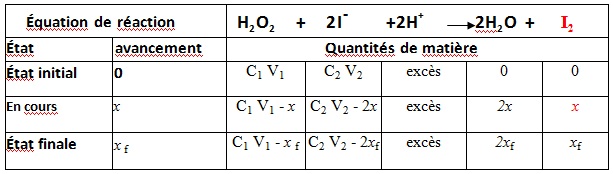
D’après le tableau d’avancement la quantité du diiode formée à un instant t est égale à x.
x(t) = n(I2)
On trace la courbe x(t) = f(t)
Suivi de l’évolution temporelle d’une transformation chimique par Conductimétrie
Rappel sur le principe de la conductimétrie
Dans une solution, la conductivité est assurée par la présence d’ions
La conductivité σ dépend de la nature et de la concentration molaire des ions présents
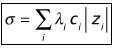


Etude la cinétique de l’hydrolyse du 2-chloro-2-méthylpropane(RCl)
On plonge une cellule conductimétrique étalonnée dans le bécher contenant le mélange eau – acétone on ajoute le 2-chloro-2-méthylpropane (RCl) dans le mélange en déclenchant le chronomètre.
- L’eau présente est en très large excès
- Le volume total de la solution dans le bécher est V = 50,0 mL
- La quantité de matière initiale est n(RCl)=9,1.10-3mol.
On relève la valeur de la conductivité σ de la solution chaque 200s
On remplit le tableau suivant:

L’équation de la réaction s’écrit:
RCl(l) + 2 H2O (l) => ROH (aq) + H3O+(aq) + Cl– (aq)
La réaction entraîne la formation d’ions H+(aq) et Cl-(aq)
Observation
La conductivité s’accentue avec l’augmentation de la concentration des ions
Établissons le tableau d’avancement
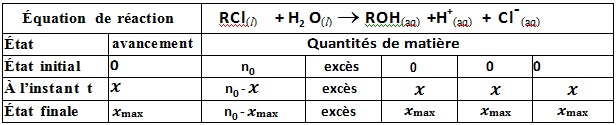
L’ eau est en excès donc le réactif limitant de la réaction est 𝑹𝑪𝒍 et l’avancement maximale est égal à 𝒙𝐦a𝐱 = 9,1.10-3mol
La conductivité de la solution à l’instant t:
𝝈(𝒕)=𝝀𝑯+.[𝑯+]𝒕 + 𝝀𝑪𝒍−.[𝑪𝒍−]𝒕
D’après le tableau d’avancement, on a :
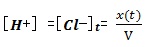
Puisque le volume de la solution est constant, alors :
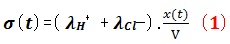
La conductivité à l’état final,
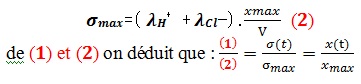
Finalement l’avancement est exprimé en fonction de la conductivité :
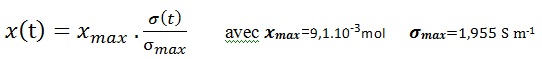
Résumé :
La mesure de la conductivité 𝝈 permet de suivre l’évolution temporelle de l’avancement de la réaction 𝒙 d’une manière continue
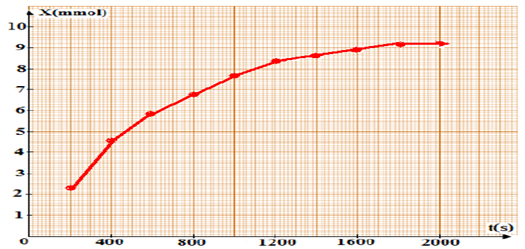
On Calcule x(t) à différents instants puis on remplit le tableau

On Trace la courbe x(𝒕)
Suivi de l’évolution temporelle d’une transformation chimique par mesure de pression d’un gaz
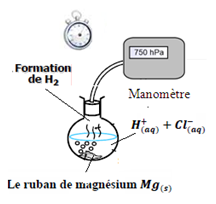
On introduit dans un ballon de 250 mL relié à un pressiomètre ( manomètre) :
- V=50,0 mL d’acide chlorhydrique de concentration C= 0,50 mol.L-1
- m=0,020g de magnésium masse molaire :M(Mg) =24,3g.mol-1
On constate que Mg réagit avec H+ avec dégagement de H2 , cette réaction dure quelques minutes jusqu’à la disparition totale du ruban de magnésium
La réaction met en jeu par les couples:
H+/H2 ; Mg2+/Mg
L’équation de la réaction s’écrit :
Mg(s) + 2 H+ → Mg2+(aq) + H2 (g) + 2 H2O (l)
Cette réaction donne un gaz de dihydrogène H2 (g)
Le manomètre nous permet de mesurer la pression à l’intérieur du ballon :
Pm = P(H2 )+Patm
La mesure de la pression Pm nous permet de suivre l’avancement de la réaction 𝒙 d’une manière continue
On relève la valeur de la pression toutes les 30 secondes durant 5 min.

Calcul des quantités de matières initiales
ni (H+ ) = C.V = 0 , 5 . 50 .10 -3 = 2 , 5 .10 -2 mol = 25 mmol
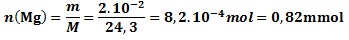
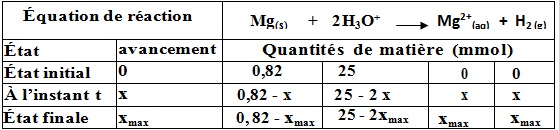
le tableau d’avancement de cette réaction:
Détermination de xmax
calcul de xmax(Mg ) theorique 0,82 – xmax =0 d’où xmax =0, 82 mmol
calcul de xmax(H+) theorique 25 – 2xmax =0 d’où xmax=12 , 5 mmol
Puisque xmax (Mg ) = 0, 82 < x max (H+ ) = 12 , 5 mmol alors Mg est le réactif limitant , la réaction continue jusqu’à la disparition totale du ruban de magnésium.
On considère le dihydrogène comme un gaz parfait donc:
P(H2 ).V = n(H2 ).R.T
Pm : La pression mesurée par le manomètre
Pm = P(H2 )+Patm P(H2 ) = Pm – Patm
À l’instant t :
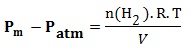
Fin de la transformation :
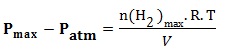
n(H2 )=x n(H2 )max= xmax
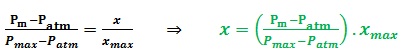
xmax= 0,82mmol Pmax=1093 hPa Patm=1013 hPa
On calcule les valeurs de x(t):
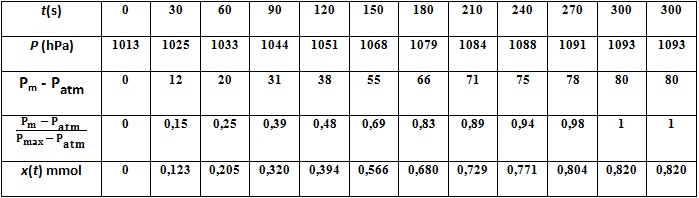
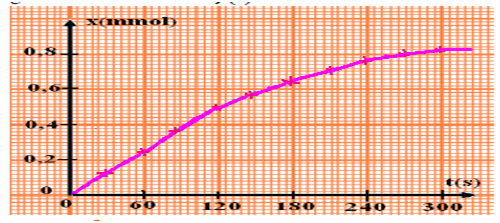
On trace la courbe x=f(t).
Suivi de l’évolution temporelle d’une transformation chimique par Spectrophotométrie
Principe de la spectrophotométrie.
Un spectrophotomètre est un appareil qui mesure l’absorbance d’une solution homogène à une longueur d’onde donnée ( λ )
Le spectrophotomètre fait passer une radiation monochromatique d’intensité I ( I étant le faisceau incident) traverse une cuve contenant la solution colorée de longueur l qui absorbe une certaine quantité de lumière donc le faisceau ressortant I d’intensité inferieur à I
On définit l’absorbance A par la formule A=log(I0/I) : grandeur sans dimension.
Le principe de la spectrophotométrie repose sur la mesure de l’absorbance A .
La loi de Beer-Lambert
L’absorbance A d’une espèce chimique en solution diluée est proportionnelle à la concentration molaire c et à l’épaisseur de la cuve ℓ de la solution:
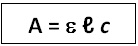
A = absorbance de la solution (sans unité) ;
e = coefficient est le coefficient d’absorption (ou d’extinction) molaire (en L.mol–1.cm–1) ;
ℓ = épaisseur de la solution traversée (en cm) ;
c = concentration molaire de l’espèce chimique (en mol.L-1).
La loi de Beer-Lambert n’est valable que si :
la solution est suffisamment diluée ;
l’absorbance ne doit pas être supérieure à 2
la lumière incidente est monochromatique ;
la solution est homogène ;
Étude de la réaction entre iodure K+(aq)+I–(aq)) et peroxodisulfate de sodium, 2 Na+ (aq) + S2O8 2-(aq)
À l’instant t = 0, on réalise un mélange à partir d’un volume V1 = 10,0 mL de solution aqueuse d’iodure de potassium, K+ (aq) + I– (aq) de concentration molaire C1 = 5,0 x 10-1 mol.L-1 et d’un volume V2 = 10 mL de solution aqueuse de peroxodisulfate de sodium, 2 Na+ (aq) + S2O8 2-(aq) de concentration molaire C2 = 5,0 x 10-3 mol .L-1
En présence d’ions péroxodisulfate S2O82-(aq), les ions iodure I– (aq) subissent une oxydation et forment du diiode I2(aq). La solution aqueuse de diiode a une couleur qui varie du jaune au brun suivant sa concentration. Cette réaction est totale, l’avancement final xf est égal à l’avancement maximal xmax.
Couples mis en jeu :
S2O82-(aq) / SO42-(aq) ; I2(aq) / I– (aq)
Les ions iodure I– réagissent avec les ions peroxodisulfate S2O8 2- (aq) selon la réaction d’équation :
2 I–(aq) + S2O82- (aq) => I2(aq) + 2 SO42- (aq)
Étude spectrophotométrique
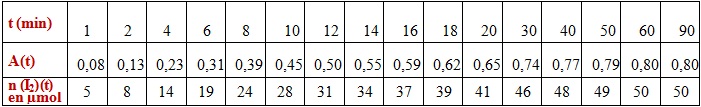
On étudie par spectrophotométrie, la formation, au cours du temps, du I2 diiode, la seule espèce colorée.
Les résultats des mesures d’absorbance en fonction du temps :
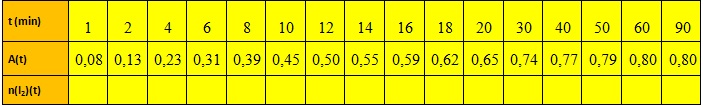
Tableau d’avancement
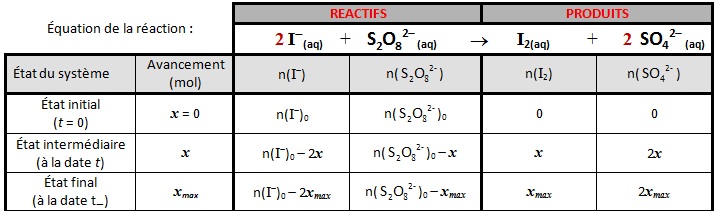
x est l’avancement de la réaction d’équation : alors n(I2)(t) = x.
D’après la loi de Beer-Lambert
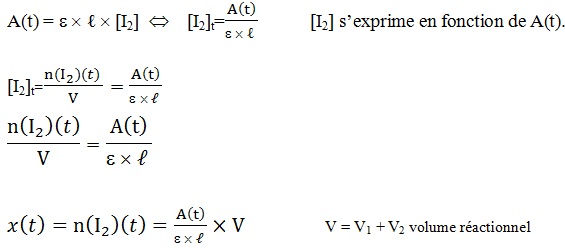
On a exprimé l’avancement 𝒙(𝒕) en fonction de A(t) donc on calcule n(I2) (t) et On remplit le tableau :
On trace de la courbe n(I2)(t) = x(t)
Vitesse de la réaction chimique
Vitesse de la réaction
La vitesse volumique d’une réaction correspond à la quantité de matière formée ou disparue par unité de temps et de volume, tel que:
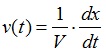
- v(t): vitesse volumique de réaction (en mol.m-3.s-1)
- V: volume de la solution (en m3)
- dx: variation de l’avancement (en mol)
- dt: durée de la variation (en s)
- Le rapport dx/dt est la dérivée de l’avancement par rapport au temps.
dx/dt : dérivée de l’avancement de la réaction par rapport au temps. (mol.s-1)
(Coefficient directeur de la tangente à la courbe à l’instant t)
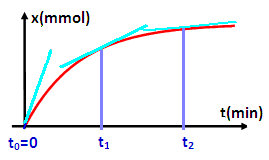
Détermination graphiquement la vitesse de la réaction:
On détermine la vitesse de la réaction à un instant donné t, en traçant la droite tangente à la courbe x=f(t) à l’instant t choisi, puis on calcule la valeur du rapport dx/dt qui représente le coefficient directeur de cette tangente, et on le divise par le volume V de la solution.
Evolution de la vitesse de réaction au cours du temps
On observe la diminution des valeurs de coefficient directeur durant la transformation et puisque la transformation se déroule dans un volume constant, alors : la vitesse de réaction diminue avec le temps.
Temps de demi-réaction
Le temps de demi-réaction, noté t½, est la durée nécessaire pour que l’avancement x de la réaction soit égal à la moitié de sa valeur finale x(t½) = ½ xfinal
Détermination graphique du temps de demi-réaction :
- On détermine la valeur de l’avancement final xf par traçage horizontale d’une asymptote à la courbe.
- On détermine Xf/2 sur la courbe
- On détermine le point d’intersection de la ligne horizontale de l’ordonnée Xf/2 avec la courbe
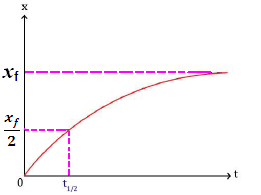
- le temps de demi-réaction t½ est l’abscisse du point d’intersection
- Le temps de demi-réaction permet l’estimation du temps nécessaire à la fin de la transformation chimique étudiée environ 𝒕𝒇=𝟏𝟎t½







