On Commence le cours de Bac Français de la cinétique Chimique
Rappel sur les réactions d’oxydoréduction
Définition d’un oxydant
Un oxydant est une espèce chimique qui peut capter un ou plusieurs électrons (accepteur d’électrons)
Définition d’un réducteur
Un réducteur est une espèce chimique capable de céder un ou plusieurs électrons (donneur d’électrons)
Couples oxydant / réducteur (ou Redox)
Dans un couple d’oxydoréduction Oxydant / Réducteur, noté Ox / Réd est constitué par un oxydant et un réducteur conjugué, caractérisé par demi-équation d’oxydoréduction.
Ox + n e↔ Réd demi-équation de réduction
Réd ↔ Ox + n e demi-équation d’oxydation
Le signe ↔ signifie qu’on peut considérer la réaction dans les deux sens
Réaction d’oxydoréduction
Une réaction d’oxydoréduction met en jeu deux couples d’oxydoréduction:
Il y a transfert d’électrons du réducteur de l’un des couples à l’oxydant de l’autre couple.
Ox1/Red1 et Ox2/Red2.
Tous les électrons cédés par le réducteur du premier couple sont captés par l’oxydant du deuxième couple. On écrira:
(x n2) réducteur 1 ↔ oxydant 1 + n1e–
(x n1) oxydant 2 + n2e– ↔ réducteur 2
____________________________________________________________________________
n2.réducteur1 + n1.oxydant 2 → n2.oxydant 1 + n1.réducteur 2
Par conséquent il n’apparaît aucun électron dans l’équation de la réaction.
Exemple
L’équation de l’oxydation des ions Fe2+ par les ions permanganate en milieu acide.
(x 5) Fe2+(aq) ↔ Fe3+(aq) +1 e–
(x 1) MnO4–(aq) + 8H+(aq) + 5e– ↔ Mn2+(aq) + 4H2O
L’équation finale:
5Fe2+(aq) + MnO4–(aq) + 8H+(aq) → 5Fe3+(aq) + Mn2+(aq) + 4H2O
Équilibrer une réaction d’oxydoréduction
Méthode pour équilibrer les équations rédox
La nécessité d’écrire la demi-réaction d’un couple rédox Ox/Red.
Ox + n e ↔ Réd avec n le nombre d’électron mis en jeu.
Les électrons sont toujours situés du côté de l’oxydant.
Les règles à suivre:
Règle 1 : conservation de la matière
le même nombre d’atome de chaque côté de l’équilibre.
Règle 2 : électroneutralité
Le même nombre de charge de chaque côté
Exemple 1
Couple S4O62-/S2O32-
Règle1 : conservation de la matière
Multiplier par 2 l’espèce S2O32- d’où : S4O62- ↔ 2 S2O32-
Règle2 : électroneutralité
S4O62- + 2 e- ↔ 2 S2O32-
La réaction est équilibrée.
Exemple 2
Couple MnO4–/Mn2+
On remarque l’oxydant contient des atomes d’oxygène alors que le réducteur non plus, donc il faut rajouter des molécules d’eau.
Règle 1 : conservation de la matière
MnO4– ↔ Mn2+ : les atomes de Mn sont équilibrés (1 de chaque côté)
MnO4– ↔ Mn2+ + 4 H2O : on rajoute 4 molécules d’eau pour équilibrer le nombre d’oxygène
MnO4– + 8H+ ↔ Mn2+ + 4 H2O : on rajoute 8 protons H+ correspondants aux 4 molécules d’eau.
Règle2 : électroneutralité
MnO4– + 8H+ + 5e– ↔Mn2+ + 4 H2O
on rajoute 5 électrons pour l’électroneutralité.
Transformations chimiques lentes et rapides
Transformations rapides
Une transformation rapide se fait en une durée trop courte, de sorte que nous ne pouvons pas suivre l’évolution à l’œil nu ou avec les instruments de mesure
Exemple1
Action d’une solution de nitrate d’argent sur une solution de chlorure de sodium
Ag+ (aq) + Cl – (aq) ↔ AgCl (s)
Ajout de quelques gouttes d’une solution aqueuse de nitrate d’argent Ag+ + NO3– à une solution de chlorure de sodium Na+ + Cl – entraîne une formation rapide d’un précipité blanc de chlorure d’argent.
Exemple 2
Réduction d’une solution de diiode I2 par une solution de thiosulfate de sodium.
Un mélange une solution de diiode I2 , couleur brun, à une solution de thiosulfate de sodium ( 2 Na+ + S2O3 2 – ) , on observe une décoloration immédiat de la solution
I2 (aq) + 2 S2O32 – (aq) → 2 I – (aq) + S4O62 – (aq)
Exemple 3
une solution violette de permanganate de potassium (K+(aq)+ Mn04– (aq) ) dans une solution de sulfate de fer(II) (Fe2+aq) + S042–(aq)).
Les couples de cette réaction: Mn04–(aq) / Mn2+(aq) et Fe3+(aq) / Fe2+(aq)
MnO4–(aq) + 8 H+ + 5 Fe2+(aq) → Mn2+(aq) + 4 H2O(l) + 5 Fe3+(aq)
La disparition rapide de la coloration violette caractéristique de l’ion Mn04–, montre qu’il se produit une réaction instantanée entre les ions Mn04–(aq) et les ions Fe2+(aq).
Transformations lentes
C’est une transformation susceptible d’être suivie à l’œil ou par des instruments de mesure, elle dure de quelques secondes à plusieurs heures.
Exemple1
Réaction entre H2 O2 eau oxygéné et les ions iodure I–
Le mélange dans un bécher de l’eau oxygénée H2 O2(𝒂𝒒) et solution aqueuse d’iodure de potassium (K+(aq)+I–(aq)) avec quelques goute d’acide entraine la formation du diiode I2(𝒂𝒒) progressivement (témoin : changement de teinte de la solution en jaune puis en marron) C’est une transformation dont l’évolution est suivie « à l’œil nu » donc la transformation est lente

La réaction met en jeu par les 2 couples:
H2 O2(𝒂𝒒) /H2 O(𝒍) et I2(𝒂𝒒) / I–(aq).
L’équation de la réaction s’écrit :
H2 O2(𝒂𝒒) + 2 I–(𝒂𝒒) + 2H+(𝒂𝒒) → I2(𝒂𝒒) + 2H2 O (𝒍)
Exemple 2
Réaction entre les ions iodure I– avec les ions peroxodisulfate S2O82–
Le mélange dans un bécher de Na2S2O8 d’une solution aqueuse d’iodure de potassium (K+(aq)+I–(aq)) Il se forme du diiode I2(𝒂𝒒) qui donne une teinte jaune puis orangée et brune.
C’est une réaction entre les ions iodure I– (incolores) et les ions peroxodisulfate S2O82– (incolores).
C’est une transformation dont l’évolution est suivie « à l’œil nu » donc la transformation est lente.
La réaction met en jeu par les 2 couples:
I2 /I– et S2O82– / SO42–
L’équation de la réaction s’écrit :
S2O8 2- (𝒂𝒒) + 2 I– (𝒂𝒒) → 2 SO42- (𝒂𝒒) + I2(𝒂𝒒)
Facteurs cinétiques
Définition facteurs cinétiques
On appelle facteur cinétique une grandeur susceptible d’influer sur la vitesse d’une transformation chimique
La concentration des réactifs et la température du système sont des facteurs cinétiques :
Plus la concentration des réactifs est élevée, plus la vitesse est élevée
Plus on augmente la concentration d’une solution, plus les molécules des réactifs sont plus nombreuses et plus la probabilité de se rencontrer pour former les produits est plus grande alors la réaction est ainsi plus rapide.
Plus la température est élevée plus la vitesse est élevée
Plus on élève la température d’une solution plus les molécules sont agitées, plus la probabilité de se rencontrer pour former les produits est plus grande alors La réaction est ainsi plus rapide.
Expérience1
Influence de la concentration des réactifs sur le facteur cinétique
Le contenu de tube A: 5 mL d’une solution de Na2S2O8 concentration molaire 0,05 mol L-1
Le contenu de tube B : 5 mL d’une solution de Na2S2O8 concentration molaire 0,05 mol L-1
La concentration molaire de tube A est égale à la concentration molaire de tube B
Le contenu de tube C : 5 mL d’une solution de KI concentration 0,1 mol L-1
Le contenu de tube D : 5 mL d’une solution de KI concentration 0,01 mol L-1
La concentration molaire de tube C est différent à la concentration molaire de tube D
On verse le contenu de A dans C et de B dans D simultanément
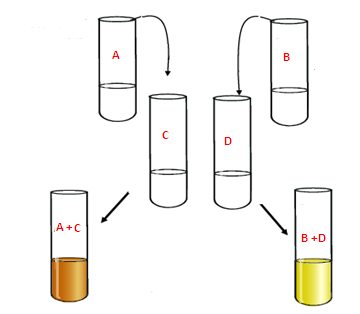
Observation de résultat :
Quel que soit l’instant t la couleur dans le mélange A+ C est plus intense que celle dans le mélange B+D
L’apparition de la couleur brune est plus rapide dans le mélange A+C que dans le mélange B+D.
Conclusion :
La concentration des réactifs est un facteur cinétique.
Experience2
Influence de la température sur le facteur cinétique
On verse le contenu de A dans C et de B dans D simultanément
Le mélange B+D est à une température ambiante 20°C
Le mélange A+C est chauffé à une température de 80°C
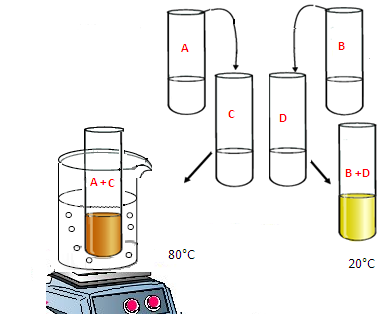
Observation de résultat :
Quel que soit l’instant t La couleur dans le mélange A+ C est plus intense que celle dans le mélange B+D
L’apparition de la couleur brune est plus rapide dans le mélange A+C que dans le mélange B+D.
Conclusion
La température est un facteur cinétique.
Suivi cinétique d’une réaction chimique
Méthode chimique
- Nécessité de dosage l’une des espèces chimiques (soit réactif ou produit) au cours de l’évolution de la réaction.
- On doit fractionner la solution de la réaction en plusieurs échantillons pour les analyser séparément aux différents dates;
- Stoppage de la réaction pour cause d’arrêter l’évolution du système réactionnel au cours de dosage, en effectue alors soit une trempe ou une forte dilution
Méthodes physiques
Suivre dans le temps l’évolution d’une transformation chimique et en particulier la détermination de x=f(t) en continu nécessite l’utilisation de certaines grandeurs physiques mesurables dépendent de la concentration de certaines espèces chimiques.
La Méthode physique nous permet un enregistrement continu de l’évolution d’un réactif ou d’un produit
Quelques méthodes physiques :
Conductimétrie : le système réactionnel doit contenir d’ions (produit ou réactif)
la mesure de la conductivité permet d’accéder à la concentration de ces ions
PH-métrie : la présence des ions oxonium H+(aq) ou H3O+ dans le milieu réactionnels
La mesure du pH donne accès à la concentration de ces ions.
La mesure de pression: Pour les réactions produisant ou consommant des gaz
Nous utilisons le manomètre pour suivre la pression du mélange réactionnel dans le temps.
Spectrophotométrie: lorsque l’une des espèces mises en jeu (réactif ou produit) est colorée
On utilise les propriétés optiques







