Cours simple et précis pour le terminale : titrage acide base par mesure de pH
Table des matières
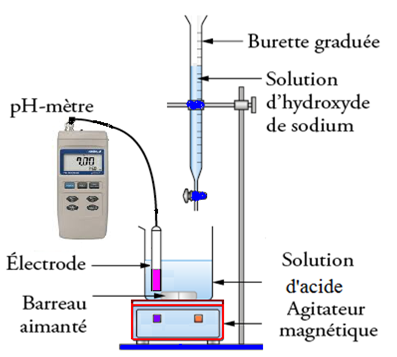
Principe Titrage Acido Basique
Pour titrer une espèce chimique, dans une solution aqueuse :
- on prélève par pro-pipette un échantillon de cette solution et on l’introduit dans un bécher déjà bien Rincer avec de l’eau distillée.
- On introduit un réactif titrant de concentration connue dans une burette graduée.
- On Rince la sonde du pH-mètre à l’eau déminéralisée, puis on l’étalonne et enfin on la plonge dans la solution titrée après fonctionnement de l’agitateur magnétique.
- On ajoute progressivement des volumes de la solution titrant et on mesure à chaque fois le pH de la solution, jusqu’à la réaction total.
Les mesures effectuées nous permettent de tracer le graphe la courbe pH = f(V)
Titrage d’un acide par une base : SUIVI pH-METRIQUE
On introduit dans un bécher, un volume VA=20,0 mL d’une solution d’acide méthanoïque HCOOH (aq) , On ajoute progressivement, à l’aide d’une burette graduée, un volume VB d’une solution d’hydroxyde de sodium NaOH de concentration CB=20,00 mmol L-1
Toutes les mesures sont faites à 25 °C
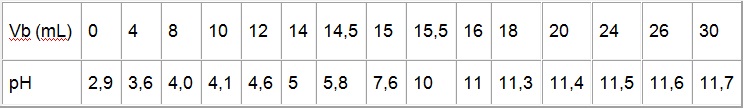
On mesure le pH de la solution obtenue après chaque ajout. On obtient les résultats suivants :
L’équation bilan de titrage
HCOOH(aq) + HO –(aq) → HCOO –(aq) + H2O(l)
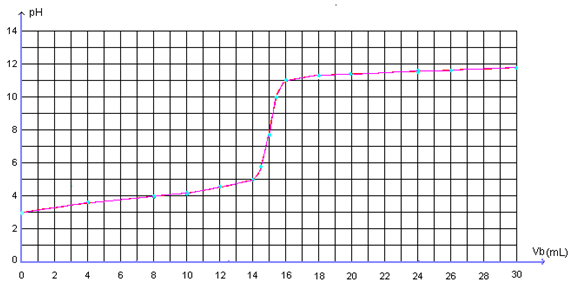
Reportons ces résultats sur un graphe :
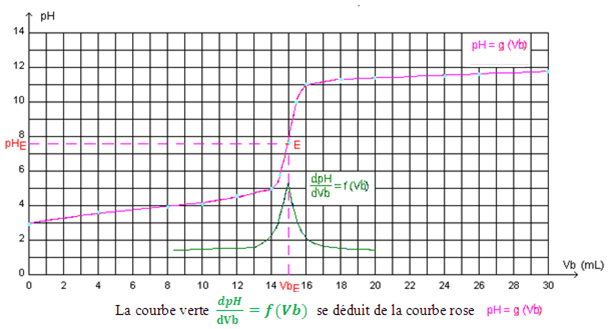
Analyse de la courbe.
La courbe obtenue présente trois parties distinctes:
- Pour 0 <Vb <14 mL, le pH varie lentement le réactif limitant est OH – , le réactif en excès HCOOH impose un pH acide
- Pour 14 <Vb < 16 mL, on observe une importante variation de pH.
- Pour Vb >16 mL, le pH augmente lentement et tend vers une valeur limite pH = 12,3 (correspondant au pH de la solution de soude ajoutée) Le réactif limitant est H3O +, le réactif en excès est OH – .
Le milieu est de plus en plus basique impose un pH basique
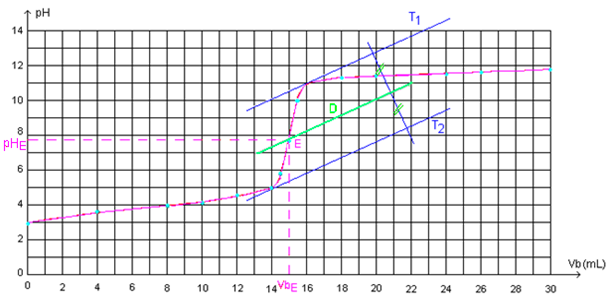
Détermination graphiquement les coordonnées du point d’équivalence E (VBE ; pHE ) par :
Méthode des tangentes : méthode (géométrique)
- On trace une tangente (T1) à la courbe juste après le point d’équivalence,
- On trace la tangente (T2),en un point situé juste avant le point d’équivalence, et qui est parallèle à la tangente (T1)
- On trace la droite (D) parallèle et équidistantes aux deux tangentes (T1) et (T2).
- L’intersection la droite (D) avec la courbe pH = f(V) détermine le point d’équivalence E qui a pour abscisse VBE et pour ordonnée pHE.
La valeur de VBE= 15mL d’après la courbe
2. Méthode de la courbe dérivée
Au point d’équivalence E , le coefficient directeur de la tangente passe donc par un maximum
Le point E qui a pour abscisse VBE et pour ordonnée pHE représente le point d’inflexion, il correspond au maximum du coefficient directeur de la tangente à la courbe.
Le calcul de ce coefficient directeur k s’écrit :
k = [pH(B) – pH(A)] / [VA(B) – VB(A)]
Pour une petite variation de volume ΔVB, on peut écrire :
k = dpH / d V
La valeur de la fonction dérivée soit dpH / d V est maximale
Le volume d’équivalent VBE représente l’abscisse du point maximum de la courbe.
En déduire la valeur de la concentration en acide éthanoïque de la solution S
A l’équivalence, on a donc la relation suivante :
CA.VA= CB.VBE
VBE= 15mL
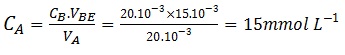
Titrage d’une base par un acide
On introduit dans un bécher, un volume VA=20,0 mL d’une solution d’ammoniac NH3 de concentration. On ajoute progressivement, à l’aide d’une burette graduée, un volume VA d’une solution d’acide chlorhydrique HCl de concentration CA=14,00 mmol L-1 . Toutes les mesures sont faites à 25 °C
L’équation bilan de titrage
NH3 + H3O+ → H2O + NH4+
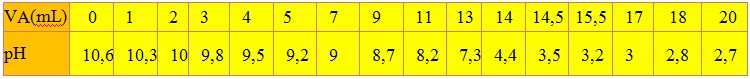
On mesure le pH de la solution obtenue après chaque ajout. On obtient les résultats suivants :
Reportons ces résultats sur un graphe :
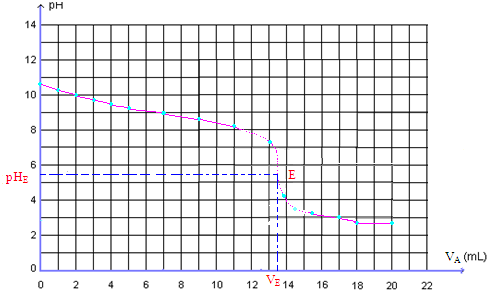
Analyse de la courbe.
La courbe obtenue présente trois parties distinctes:
- Pour 0 <VA <13 mL, le pH varie lentement le réactif limitant est H3O+ , le réactif en excès NH3 impose un pH basique.
- Pour 13 <VA < 15 mL, on observe une importante variation de pH.
- Pour VA >15 mL, le pH diminue lentement vers et tend vers une valeur limite, pH = 2,7 (correspondant au pH de la solution d’acide ajoutée)
Le réactif limitant est NH3 , Le réactif en excès est H3O+, le milieu est de plus en plus acide impose un pH acide
Titrage Colorimétrique
Principe titrage colorimétrique
Pour suivre le titrage acido-basique en utilisant un indicateur coloré convenablement choisi, on ajoute quelques gouttes d’indicateur coloré à la solution titrée, puis on introduit progressivement la solution titrante en agitant le mélange, jusqu’au changement de teinte
Lors du titrage colorimétrique, l’équivalence est repérée par le changement de couleur d’un indicateur coloré ajouté dans la solution titrée.
Le critère de choix d’un indicateur coloré
En général, l’indicateur coloré convient au titrage acido-basique si sa zone de virage contienne la valeur pHE à l’équivalence.
Pour éviter de fausser la détermination du volume équivalent, on introduit seulement quelques gouttes d’une solution diluée d’indicateur dans la solution titrée.







