Rappel sur le quotient de réaction Qr
Le quotient de réaction Qr dans un état donné à l’instant t pour une réaction chimique d’équation: a A+ b B⇋ c C+ d D est donné par la relation suivante :
à l’équilibre les concentrations molaires des espèces chimiques restent constantes et le quotient de la réaction Qr prend une valeur constante qu’on appelle la constante d’équilibre Qr,éq qu’on note :K= Qr,éq
La valeur de la constante d’équilibre K ne dépend que de la nature de réactifs et la température.
Critère d’évolution spontanée d’un système chimique
Le système évolue spontanément vers un état d’équilibre K.
La valeur du quotient de réaction Qr,i tend vers la constante d’équilibre K.
Comment prévoir le sens d’évolution d’un système?
On compare la valeur du quotient de réaction dans l’état initial Qr,i, et la valeur de la constante d’équilibre K.
Si Qr,i < K , le système évolue dans le sens direct de l’équation de la réaction (sens qui fait augmenter Qr ) jusqu’à ce que Qr = K , c’est-à-dire augmentation les concentrations en produits « C et D » et diminution des concentrations en réactifs « A et B »
Si Qr,i > K , le système évolue dans le sens inverse de l’équation de la réaction « qui fait diminuer Qr » jusqu’à ce que Qr = K ( augmentation de concentrations en réactifs « A et B » et diminution de concentrations en produits « C et D » )
Si Qr,i = K , le système n’évolue pas.
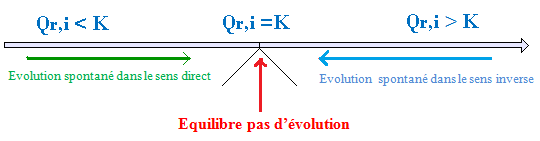
Conclusion,
la connaissance de Qr,i et de K permettent de prévoir le sens d’évolution du système
Application du critère d’évolution spontanée
Réaction acido-basique
Etude du sens d’évolution spontanée d’une réaction acido-basique entre l’acide éthanoïque et l’ammoniac
L’équation de la réaction:
CH3COOH(aq) + NH3(aq) ⇋ CH3COO–(aq) + NH4+(aq)
Pour le couple : CH3COOH(aq) / CH3COO–(aq), pKA1 = 4,8
Pour le couple : NH4+/NH3 : pKA2 = 9,2
On prépare une solution d’un mélange de :
- acide éthanoïque CH3COOH(aq) : V1 = 10 mL C1 = 5.10-2 mol.L-1
- ammoniac NH3(aq) V2 = 5 mL C2 = 5.10-2 mol.L-1
- éthanoate de sodium (CH3COO–(aq) ; Na+(aq)) V3 = 5 mL C3 = 10-1mol.L-1
- chlorure d’ammonium (NH4+(aq) +Cl–(aq)) V4 =10 mL C4 =10-1mol.L-1
Questions
- Écrire l’expression du quotient de réaction à l’état initial Qr,i et calculer sa valeur
- Déterminer la valeur de la constante d’équilibre
- Déterminer le sens d’évolution spontanée de ce système
Réponses:
1. L’expression du quotient de réaction à l’état initial s’écrit:
Volume total de la solution : VT=V1+V2+V3+V4
d’où l’expression du quotient de réaction à l’état initial égal à:
2. La valeur de la constante d’équilibre s’exprime:
3. Puisque Qr,i < K , alors le système évolue dans le sens direct ( sens de l’augmentation les concentrations de CH3COO–(aq) ; NH4+(aq) et diminution les concentrations de CH3COOH(aq) ; NH3(aq) .
Réaction d’oxydoréduction
Etude du sens d’évolution spontanée d’une réaction d’oxydoréduction
On introduit dans un bécher :
- ions de zinc Zn2+(aq) V1 = 200 mL C1 = 2,0.10-1 mol.L-1
- ions d’aluminium Al 3+(aq) V2 = 200 mL C2 = 1,5.10-2 mol.L-1
- Une plaque de Zinc Zn(s) et une plaque d’aluminium Al (s)
L’équation de la réaction chimique s’écrit :
2 Al (s) + 3 Zn2+(aq) ⇋ 2Al 3+(aq) + 3 Zn(s)
la constante d’équilibre de cette réaction est : K = 4.1038
Questions
- Déterminer la valeur de quotient de réaction dans l’état initial Qr.i
- Dans quel sens le système va-t-il évoluer ?
Réponses:
1- L’expression du quotient de réaction à l’état initial s’écrit:
Volume total de la solution : VT=V1+V2=0,4 L
d’où l’expression du quotient de réaction à l’état initial égal à:
Qr.i =5,6.10-2
2- Puisque Qr,i < K, alors le système évolue dans le sens direct ( sens de la formation de zinc métallique et d’ions d’aluminium )







