Insuffisance de la mécanique classique
Les lois de Newton restent impuissantes pour justifier l’identité des atomes, elles ne sont pas utilisable à l’échelle atomique et moléculaire pour expliquer quelques phénomènes physique comme l’échange énergétique entre la matière et la lumière.
Quantification des niveaux d’énergie
Au début du XX siècle, les physiciens procèdent à l’expérience suivante:
On éclaire un métal avec un faisceau lumineux celui- ci peut éjecter des électrons par contre lorsqu’on fait varier la longueur d’onde λ, il existe une longueur d’onde seuil λs au-delà de laquelle rien ne se passe
c’est-`a-dire lorsqu’on applique un faisceau lumineux de longueur d’onde λ ≤ λs des électrons sont éjectés même si la puissance est très faible. par contre il existe une longueur d’onde seuil λs au-delà de laquelle aucun ´électron n’est éjectée même si on augmente la puissance lumineuse.
Albert Einstein donne, en 1905, une explication à ce phénomène :
Les échanges entre la lumière et la matière se font par l’absorption ou l’émission d’un quanton appelé photon, dont l’énergie est E = hν.
les échanges ne peuvent se faire que par paquets d´énergie « quantum d´énergie E » dépendant de la fréquence. La lumière est constitué de corpuscules appelés photons , porteurs d’énergie
Les électrons qui absorbent ces photons acquièrent cette énergie
A chaque photon correspond une onde électromagnétique de longueur d’onde λ, de fréquence ν et de célérité c dans le vide (c=3,00.108 m.s-1). Un photon a une masse nulle et une énergie E avec h = 6,62.10-34 J.s, appelée constante de Planck
Pour l’énergie de photon est exprimé souvent en l’électron-volts
Applications aux spectres atomiques
Expérience
L’hydrogène, à basse pression, éclairé par de la lumière blanche qui est constituée d’une infinité de radiations monochromatiques « lumière dont le spectre est continu ».
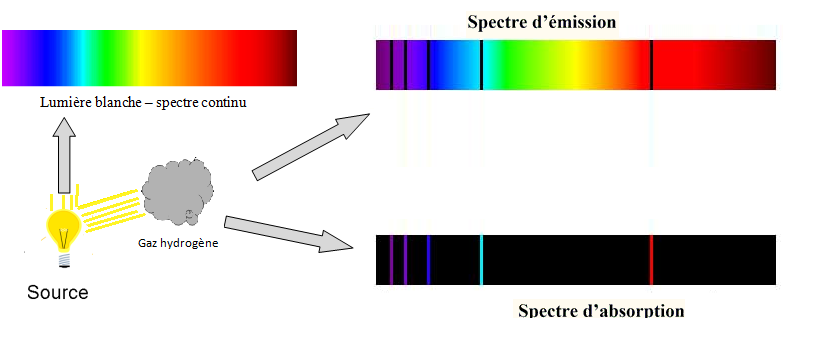
On observe comme résultat deux spectres:
Spectres d’absorption :
Des atomes éclairés par de la lumière blanche pourront absorber certaines radiations lumineuses
donc le spectre de la lumière traversant le gaz d’hydrogène présentera alors des raies noires.
Spectres d’émission :
Pour le spectre d’émission atomique d’hydrogène on remarque qu’il comporte des raies dont les longueurs d’ondes sont identiques à celles présentes dans le spectre d’absorption « des raies noires ».
Explication
L’analyse spectrale montre que les photons absorbés sont composées de radiations de certaines fréquences discrètes bien déterminées, cela montre qu’un atome ne peut absorber de l’énergie que si celle-ci permet à un électron de passer d’un niveau d’énergie à un autre. On dit que les énergies de l’atome sont quantifiées « quanta d’énergie »
Le physicien Niels Bohr , énonce les postulats permettant d’interpréter les raies de spectre de l’atome d’hydrogène :
Postulat des orbites
A chaque orbite permise correspond un niveau énergétique déterminé : L’énergie de l’atome est quantifiée
L’atome ne peut exister que dans certains états d’énergies bien défini ; chaque état est caractériser par niveau d’énergie .
Postulat des émissions et absorptions d’énergie de Bohr
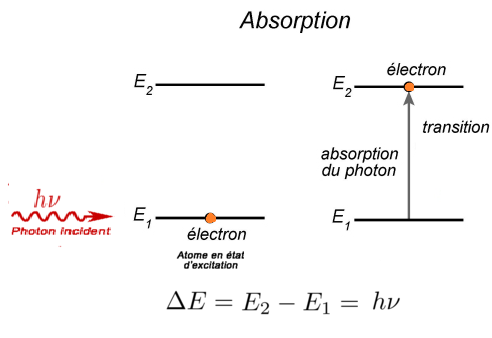
La transition d’un électron d’une orbite vers une autre se fait par saut et est accompagnée de l’émission ou de l’absorption d’un photon d’énergie : ΔE =Ef−Ei =h.ν = h.c / λ
- Ei = énergie correspondant au niveau de départ
- Ef = énergie correspondant au niveau d’arrivée
- ν= fréquence du rayonnement émis ou absorbé
- h : constante de Planck h = 6,62.10-34 J.s
Un atome peut absorber de l’énergie lumineuse : il subit alors une transition d’un niveau d’énergie Ei à un niveau d’énergie supérieur Ef
Il y a émission de lumière lorsque, après avoir été excité, l’atome subit une transition d’un niveau d’énergie Ei à un niveau d’énergie inférieur Ef
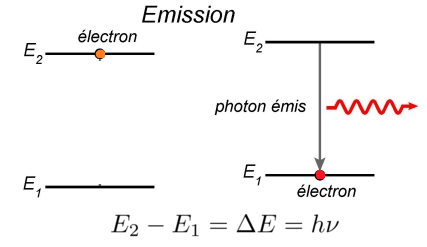
Au cours d’une transition, un atome ne peut émettre ou absorber qu’un seul quantum d’énergie lumineuse. Ces quanta ont certaines valeurs discrètes et par conséquent, les longueurs d’ondes ont bien aussi des valeurs particulières.
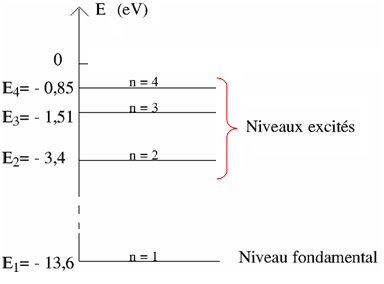
Le diagramme d’énergie de l’atome d’hydrogène
Bohr en 1913 élabore une théorie quantifier l’énergie de l’atome d’hydrogène par la relation
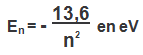
n : entier naturel, non nul, correspond au numéro de la couche occupée par l’unique électron de l’atome d’hydrogène.
n = 1 est le niveau fondamental E1 = – 13,6 eV. est l’état de plus basse énergie
Dans son état « normal », l’atome est à son niveau d’énergie le plus bas « état fondamental » .
Dans les niveaux supérieurs, l’atome est dans un état excité.