cours et exercices corrigés : état d’équilibre d’un système chimique.
Quotient de réaction Qr
Quotient de réaction Qr est une grandeur qui caractérise un système chimique. Il nous renseigne sur l’évolution du système au cours de la transformation chimique ; Qr peut être calculé n’importe quel moment.
Définition
On considère la réaction limitée (non total) modélisée par la réaction suivante :
a A + b B ⇋ c C + d D
Les réactifs A, B, et C, D les produits sont en solution aqueuse
a, b, c et d sont les nombres stœchiométriques.
Le quotient de réaction a alors pour expression :
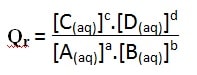
Dans l’écriture de Qr le solvant eau ou les solides n’interviennent pas Seulement les concentrations molaires des espèces dissoutes qui interviennent
– Qr : grandeur sans dimension
– [A ], [ B ], [ C ],[ D ] : concentrations effectives en mol.L-1
– [Xi] = 1 si Xi est un solide non dissous
–[H2O]=1 dans le cas d’une solution aqueuse (H2O solvant)
Exemples en cas de milieu homogène
Exemple 1
Soit la réaction de dissolution de l’acide éthanoïque dans l’eau :
CH3COOH(aq) + H2O <=> CH3COO–(aq) + H3O+(aq)
Le quotient de réaction a alors pour expression:
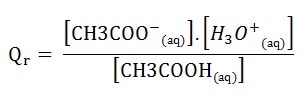
Le solvant n’intervient pas dans l’écriture du quotient de réaction.
Exemple 2
Soit la Réaction en solution aqueuse entre l’ion iodure I–(aq) et l’ion péroxodisulfate S2O82-(aq)
les couples rédox S2O82-(aq) / SO42-(aq) et I2 (aq) / I–(aq).
S2O82-(aq) + 2 I–(aq) <=> 2 SO42-(aq) + I2 (aq)
Le quotient de réaction est donné par la relation:
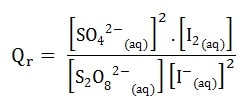
Qr est un nombre sans unité (sans dimension).
Exemple 3
Réaction, en solution aqueuse, entre la base éthanoate et l’acide méthanoïque.
Ce système peut s’évoluer dans deux sens :
- Sens de formation d’acide méthanoïque ( 1 ) :
réaction entre l’acide éthanoïque et l’ion méthanoate.
HCOO–(aq) + CH3COOH(aq) <=> HCOOH (aq) + CH3COO– (aq) .
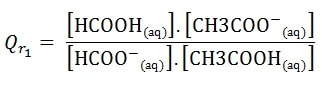
- 2- Sens de formation d’acide éthanoïque ( 2 )
réaction entre l’acide méthanoïque et l’ion éthanoate.
HCOOH(aq) + CH3COO–(aq) <=> HCOO–(aq) + CH3COOH(aq).
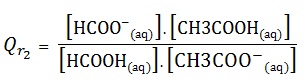
On constate que :
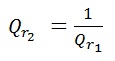
En général, le quotient de réaction dépend du sens d’écriture de l’équation de la réaction.
Exemples en cas de milieu non homogène
Pour un corps solide 𝑿 dans une solution, on prend par convention [𝑿]=𝟏 et n’apparaît donc pas dans l’expression de Qr
Exemple 1 :
Soit la réaction de précipitation de l’hydroxyde de fer (III) en solution aqueuse
Fe3+(aq) + 3 OH–(aq) <=> Fe(OH)3 (s)
Le quotient de réaction a alors pour expression:
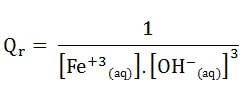
Exemple 2 :
Soit la réaction d’oxydation du cuivre Cu(S) par les ions argent Ag(S)
Cu(S) + 2 Ag+ (aq) <=> Cu2+ (aq) + 2 Ag(S)
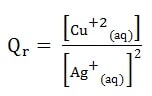
Les espèces chimiques à l’état solide n’interviennent pas dans l’écriture du quotient de réaction
Exercice d’application :
Soit la solution de la réaction en solution aqueuse volume V=20mL entre l’ion iodure I–(𝒂𝒒) et l’ion péroxodisulfate S2O82-(aq). de couples rédox S2O82-(aq) / SO42-(aq) et I2 (aq) / I–(aq).
L’équation de la réaction s’écrit :
S2O8 2- (𝒂𝒒) + 2 I– (𝒂𝒒) <=> 2 SO42- (𝒂𝒒) + I2(𝒂𝒒)
- Donner l’expression du quotient de réaction Qr
- Exprimer les concentrations des réactifs et des produits en fonction de l’avancement de réaction 𝒙 et les quantités de matière initiales.
- Déduire l’expression de Qr en fonction de 𝒙.
Solution
- Le quotient de réaction de cette transformation chimique est donné par la relation:
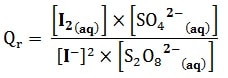
Les concentrations doivent être exprimées en mol.L-1, le quotient de réaction Qr est un nombre sans unité (sans dimension).
Tableau d’avancement
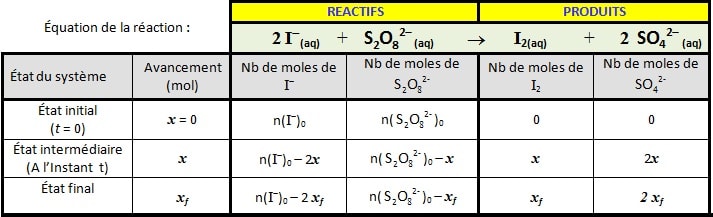
- 2- Les concentrations des réactifs et des produits en fonction de l’avancement de réaction 𝒙 et les quantités de matière initiales :

- 3- L’expression Le quotient de réaction en fonction de l’avancement de réaction 𝒙 et les quantités de matière initiales :
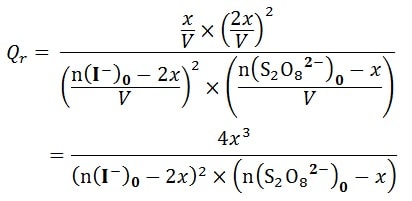
La valeur du quotient de réaction calculée à un instant t dépend donc de l’avancement x de la réaction à cet instant. La valeur de x est mesuré expérimentalement soit par conductimetrie , pH-mètre , titrage ou spectrométrie
Quotient de réaction dans l’état d’équilibre
1) Définition :
Le quotient de réaction à l’équilibre, noté Qr,éq, est la valeur que prend le quotient de réaction au moment où l’état d’équilibre du système chimique est atteint : (les concentrations molaires des espèces en solution ne varient plus).
La détermination des concentrations de la solution en équilibre est réalisée par diverses méthodes chimiques ou physiques (dosages, pH-métrie, conductimétrie, spectrophotométrie,…).
2-Détermination du quotient Qr,éq par conductimétrie
Principe général.
Le conductimètre nous permet de mesurer la conductance G de l’électrolyte, (exprimée en Siemens, de symbole S).. La mesure de G permet le calcul de la conductivité σ (en S.m-1) de la solution ionique par la relation : G=k × σ
k constante de cellule ( k=S/L ) en m–1 , L distance entre les plaques de la cellule en m et S, surface d’une plaque en m2
σ est une grandeur caractéristique d’une solution ionique :
A une température donnée, la conductivité σ (en S.m-1) dépend de la concentration des différents ions Xi de la solution et de leur conductivité molaire ionique λi selon la formule :
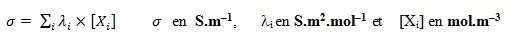
- La mesure conductimétrique nous permet donc de connaître les concentrations des espèces ioniques en solution et de déduire le quotient de réaction à l’équilibre Qr,éq
Exercice d’application
On immerge la cellule conductimétrique dans un volume V d’une solution S d’acideéthanoïque CH3COOH de concentration C=5.10-2 mol L-1, et on trouve, à 25°C, que la conductivité de cette solution est : 𝝈=343 μS.cm-1.
On donne : à la température 25°C
λ H3O+ = 35,0 mS.m2.mol-1 et λ CH3COO– = 4,09 mS.m2.mol-1
– Déterminer, dans l’état d’équilibre, les concentrations molaires effectives des espèces chimiques dissoutes
– Déterminer le quotient de réaction à l’équilibre Qr,éq
Soit la réaction de dissolution de l’acide éthanoïque dans l’eau :
CH3COOH(aq) + H2O(l) <=> CH3COO–(aq) + H3O+(aq)
Le tableau d’avancement de la réaction :

A l’état d’équilibre
Les concentrations des espèces en solution à l’état d’équilibre ne varient plus, on les note :
[CH3COOH]éq ; [CH3COO– ]éq et [H3O+]éq xf = xéq
La conductivité σ de la solution à l’équilibre :
σ = λH3O+ .[H3O+]éq + λCH3COO–. [CH3COO– ]éq
D’après le tableau d’avancement : [CH3COO– ]éq =[H3O+]éq
donc σ = (λH3O+ + λ CH3COO–) .[H3O+]éq
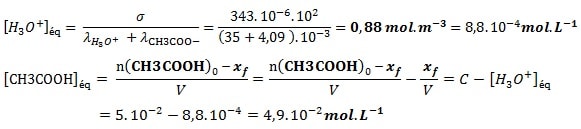
Le quotient de réaction à l’équilibre :
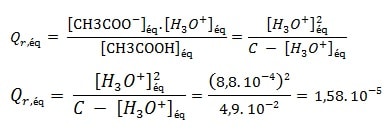
Constante d’équilibre associée à une transformation chimique
Influence de l’état initial sur le quotient de réaction à l’état d’équilibre
On mesure la conductivité σ i des solutions d’acide éthanoïque de diverses concentrations, à la température 25° et on obtient les résultats suivants :
| 𝑪 (𝒎𝒐𝒍 / 𝑳 ) | 10,0.10-3 | 5,0.10-3 | 1,0.10-3 |
| 𝝈 (𝒎𝑺 / 𝒎 ) | 15,3 | 10,7 | 4,7 |
On va déterminer la concentration molaire en ions oxonium.[H3O+]éq dans chaque solution, à l’équilibre, et déduire la valeur du quotient de réaction Qr,éq pour chaque solution. On donne à la température 25°C
A l’aide des équations calculées précédemment on détermine :
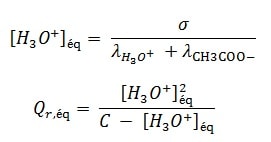
On remplit le tableau suivant avec les résultats calculés:
| 𝑪 (𝒎𝒐𝒍 / 𝑳 ) | 10,00. 10-3 | 5,00. 10-3 | 1,00. 10-3 |
| [𝑯𝟑𝑶+]é𝒒 (𝒎𝒐𝒍 / 𝑳 ) | 0,39. 10-3 | 0,27. 10-3 | 0,12. 10-3 |
| Qr,eq | 1,58. 10-5 | 1,54. 10-5 | 1,56. 10-5 |
On remarque que la valeur du quotient de réaction à l’équilibre Qr,éq est constante donc, elle ne dépend pas de l’état initial du système chimique.
La constante d’équilibre
D’abord, le quotient de réaction Qr,éq à l’équilibre, prend la valeur de la constante d’équilibre K où K = Qr,éq .
Pour une réaction en solution aqueuse d’équation chimique suivante :
a A + b B ⇋ c C + d D
La constante d’équilibre s’écrit sous la forme :
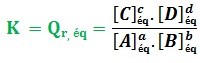
- La valeur de la constante d’équilibre K ne dépend que de la nature de réactifs et la température.
- On considère que la réaction est totale si K >104
Le taux d’avancement final à l’état d’équilibre
Influence de l’état initial
On mesure la conductivité σ de trois solutions d’acide éthanoïque de diverses concentrations, à la température 25°C , et on obtient les résultats suivants :
| 𝑪 (𝒎𝒐𝒍 / 𝑳 ) | 10,0.10-3 | 5,0.10-3 | 1,0.10-3 |
| 𝝈 (𝒎𝑺 / 𝒎 ) | 15,3 | 10,7 | 4,7 |
Le taux d’avancement d’une réaction est égal :
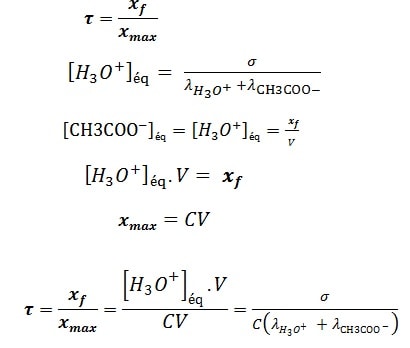
On écrit les résultats dans le tableau suivant :
| 𝑪 (𝒎o𝒍 / 𝑳 ) | 5,00.10-2 | 10,00. 10-3 | 5,00. 10-3 |
| [𝑯𝟑𝑶+]é𝒒 (𝒎𝒐𝒍 / 𝑳 ) | 0,88.10-3 | 0,39. 10-3 | 0,27. 10-3 |
| 𝝉 | 0,018 | 0,039 | 0,054 |
On remarque que lorsque la concentration de la solution diminue, La valeur du taux d’avancement final τ augmente.
On conclut que le taux d’avancement final τ dépend des conditions initiales
Influence de la constante d’équilibre
On prend deux solutions acides (S1) acide éthanoïque et (S2) acide méthanoïque de même concentration C = 𝟏, 𝟎. 𝟏𝟎−𝟐 𝒎𝒐𝒍. 𝑳−𝟏.
| Solutions | Constantes d’équilibre 𝑲 | La Conductivité 𝝈 (𝝁𝑺/𝒄𝒎 ) |
| (S1) | 1,6.10-5 | 153 |
| (S2) | 1,6.10-4 | 510 |
Le tableau d’avancement de la réaction entre l’acide HA et l’eau :
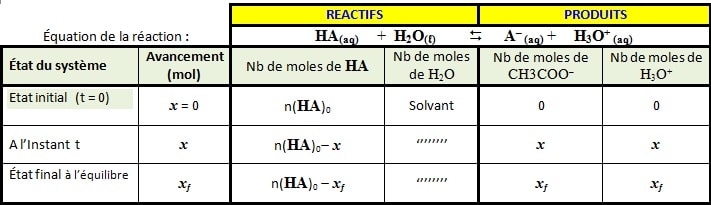
Réaction acide méthanoïque
HCOOH(aq) + H2O(l) <=> HCOO–(aq) + H3O+(aq)
Réaction acide éthanoïque
CH3COOH(aq) + H2O(l) <=> CH3COO–(aq) + H3O+(aq)

- Le taux d’avancement réaction acide éthanoïque
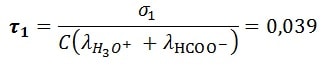
- Le taux d’avancement réaction acide méthanoïque
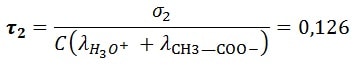
On constate d’après le tableau plus la constante d’équilibre est grande plus la conductivité est grand et plus le taux d’avancement final τ augmente
Conclusion
Le taux d’avancement final τ d’une réaction dépend de la constante d’équilibre K, plus la constante d’équilibre est grande, plus le taux d’avancement final est élevé.
Si vous avez des questions, Merci de laisser un commentaire, l’équipe COURSUNIVERSEL vous répondrez le plutôt possible







